

Structure biology in cellular signaling and membrane trafficking
National Chung Hsing University Assistant Professor 2024.08.01~
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) Post-Doctoral Researcher 2018.04-2024.07.31
Genomic Research Center, Academia SINICA Research Assistant 2009.07-2012.04
磷酸肌醇轉化 X Small GTPases:
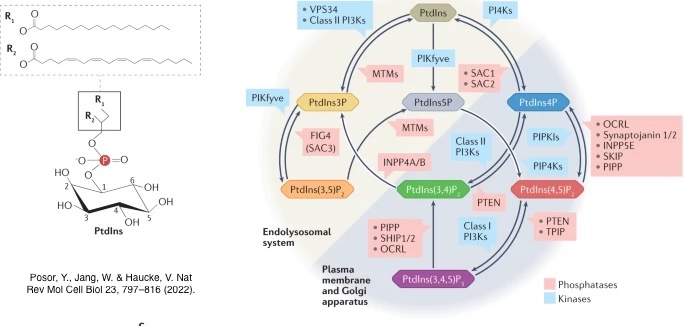
細胞是構成生物組織的基本單位。細胞膜以及內部胞器承載各式各樣的脂類信與其作用蛋白,進而傳遞細胞內外的信息,調節細胞的各種生理功能。其中脂類磷酸肌醇 (Phosphoinositides, PIs) 是無數生物訊號的主要調節信使,磷酸肌醇共有七種不同的種類:三種單磷酸磷脂酰肌醇磷酸鹽 (PI3P, PI4P; PI5P)、三種雙磷酸鹽 [PI(3,4)P2, PI(4,5)P2 and PI(3,5)P2] 以及一種三磷酸鹽[PI(3,4,5)P3],經由負責的激酶或是磷酸水解酶七種不同的磷酸肌醇可以互相轉換 (如下圖)。磷酸肌醇在細胞內的分佈猶如通關號碼般定義了不同胞器的身份,同時搭配不同的small GTPases (大於150個不同的種類)進行訊息調控,大家可以想像這些訊息過程就像遊戲闖關時,需要提供關主(small GTPases)對的通關密碼(PIs)才可以過關。目前研究指示這些轉換的途徑如果失調可以導致許多的疾病,最常見的疾病,例如:癌症、糖尿病、神經及肌肉功能失調。因此了解磷酸肌醇轉換的調節機制將有廣泛的醫療運用。
研究興趣:
第二型磷酸化磷脂酰肌醇3-激酶 (Class II PI3-kinases) 有三個不同的異構體 (isoforms),在細胞內有個別的作用位置以及獨特的功能,並且是疾病治療的潛在標靶,例如:癌症、糖尿病、血栓、中風急救、類風濕性關節炎。
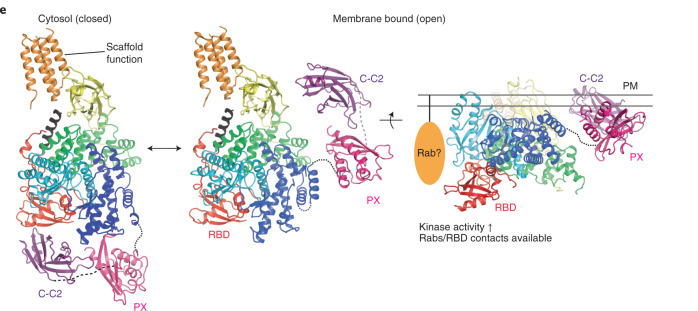
目前針對Class II PI3-kinase ɑ isoform (PI3KC2ɑ)結構解析,我們了解了Class II PI3-kinases普遍的如何自我調節活性 (如下圖),但我們仍然不清楚Class II PI3-kinases在膜上的活化機制,甚至Class II PI3-kinases所產生的脂質訊號是如何被終止的。因此實驗室將會針對磷酸肌醇轉換酶,例如 :Kinases: Class II PI3kinases, Phosphatases: MTM/MTMR complexes; INPP4A/B, 進行從細胞內蛋白質體 (proteomics) 分析,配合生化分析蛋白結構分析去了解以上酵素活性如何被鳥糞嘌呤核苷三磷酸酶 (small GTPases), 例如 :Rab GTPases活化或是抑制。此研究將為未來藥物發展鋪路,以達到最終目的是發展小分子藥物或是奈米抗體 (nanobody) 藥物去活化或抑制細胞內的磷酸肌醇轉換。我相信未來有機會廣範的使用於疾病治療,像是抑制癌細胞成長、轉移… 等。
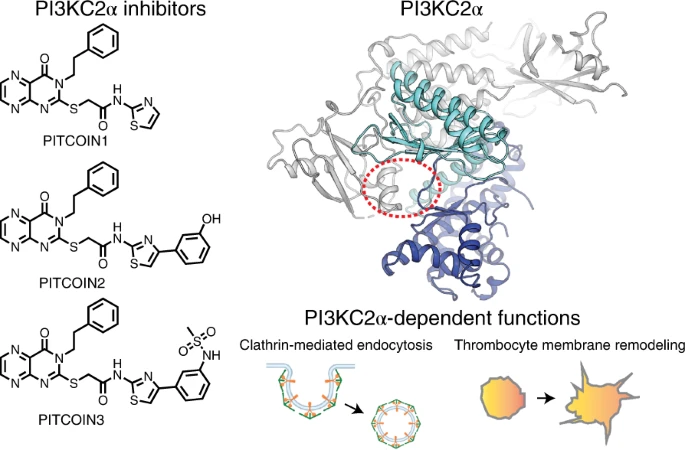
此外本實驗室與德國柏林萊布尼茲生物藥學研究所建立class II PI3-kinase小分子藥物開發的研究,我們目前已成功利用蛋白質工程協助蛋白結晶,並利用X-ray 晶體結構解析class II PI3-kinase與小分子藥物的複合體結構,此研究過程協助我們利用結構解析來了解藥物結合的方式,並協助我們進一步的修飾優化藥物的化學結構,以達到發展有效並專一的小分子藥物。目前利用大量藥物篩選配合此研究方式,我們已經開發出一系列PI3KC2ɑ的專一抑制劑(PITCOINs),並成功使用PITCOIN於抑制PI3KC2ɑ的相關功能研究,例如:胞吞、乳癌細胞轉移、抗血栓、細胞分裂,見下圖。 延續PI3KC2ɑ的藥物開發,我們正在研發PI3KC2β的小分子藥物,並期待能廣泛運用於中風急救。
研究內容將包含:
- 細胞生理方面:細胞內囊泡傳遞、細胞分裂
- 蛋白質體方面:APEX- proximity labelling using CRIPR-CAS9 mediated knocked-in cell lines
- 結構生物學方面:X-ray 晶體結構解析、single particle cryo-EM、hydrogen-deuterium MS/MS (HDX-MS/MS)
Freie Universität Berlin (Germany) Chemistry and Biochemistry Dr. rer. Nat (Ph.D) 2012.06-2018.03
National Chung Hsing University Institute of Biochemistry Master of Science 2005.09-2007.07
National Kaohsiung Normal University Department of Chemistry Bachelor 2001.09-2005.06
2024 Yushan Young Scholar
Lo WT#, Belabed H#, Kücükdisli M, Metag J, Roske Y, Prokofeva P, Ohashi Y, Horatscheck A, Cirillo D, Krauss M, Schmied C, Neuenschwander M, von Kries JP, Médard G, Kuster B, Perisic O, Williams RL, Daumke O, Payrastre B, Severin S, Nazaré M, Haucke V. Development of selective inhibitors of phosphatidylinositol 3-kinase C2α. Nature Chemical biology. 19(1):18-27. 2023.01
Lo WT, Zhang Y, Vadas O, Roske Y, Gulluni F, De Santis MC, Zagar AV, Stephanowitz H, Hirsch E, Liu F, Daumke O, Kudryashev M, Haucke V. Structural basis of phosphatidylinositol 3-kinase C2α function. Nature Structural and Molecular Biology. 29(3):218-228. 2022.03
Samsó P, Koch PA, Posor Y, Lo WT, Belabed H, Nazare M, Laporte J, Haucke V. Antagonistic control of active surface integrins by myotubularin and phosphatidylinositol 3-kinase C2β in a myotubular myopathy model. Proc Natl Acad Sci USA (PNAS) 119(40): e2202236119. 2022.10
Li H, Prever L, Hsu MY, Lo WT, Margaria JP, De Santis MC, Zanini C, Forni M, Novelli F, Pece S, Di Fiore PP, Porporato PE, Martini M, Belabed H, Nazare M, Haucke V, Gulluni F, Hirsch E. Phosphoinositide Conversion Inactivates R-RAS and Drives Metastases in Breast Cancer. Advanced Science. Mar;9(9):e2103249. 2022.03
Gulluni F, Prever L, Li H, Krafcikova P, Corrado I, Lo WT, Margaria JP, Chen A, De Santis MC, Cnudde SJ, Fogerty J, Yuan A, Massarotti A, Sarijalo NT, Vadas O, Williams RL, Thelen M, Powell DR, Schueler M, Wiesener MS, Balla T, Baris HN, Tiosano D, McDermott BM Jr, Perkins BD, Ghigo A, Martini M, Haucke V, Boura E, Merlo GR, Buchner DA, Hirsch E. PI(3,4)P2-mediated cytokinetic abscission prevents early senescence and cataract formation. Science. 374(6573):eabk0410. 2021.10
Wang H#, Lo WT#, Haucke V. Phosphoinositide switches in endocytosis and in the endolysosomal system. Current Opinion in Cell Biology. 59:50-57. 2019.08